澳洲医疗器械TGA注册怎么办理?流程怎么样?
类别:行业资讯
文章出处:CTC华商检测
发布时间:2024-11-04 15:54:40
浏览人次:0


澳大利亚拥有强大的医疗保障体系,完备的医疗管理和保险体系为人民提供着完整的医疗卫生服务。目前所有在澳大利亚上市的医疗用品(药品和医疗器械)必须按有关要求,向澳大利亚医疗用品管理局提出注册或登记申请,获得注册登记(Australian Register of Therapeutic Goods,ARTG)后才能合法上市,以确保医疗器械的安全和有效得到保障。接下来华商检测小编带大家详细地了解澳大利亚TGA医疗器械注册。
主管机构及法规
监督机构 :TGA 是Therapeutic Goods Administration的简写,全称是医疗用品管理局,它是澳大利亚的医疗用品(包括药物、医疗器械、基因科技和血液制品)的监督机构。
法案法规要求:
- Therapeutic Goods Act 1989-the Act;
- Therapeutic Goods(Medical Devices)Regulations 2002-the Regulations。
监管途径:上市前通知/注册。
授权代表:Austrialian Sponsor 澳大利亚代理(澳代)--持证人,只负责法规注册, 不涉及商品后续市场的销售,有别于经销商的角色。
QMS 要求:Medical Device Single Audit Program (简称MDSAP)医疗器械单一审核程序。
澳大利亚医疗器械分类标准:
制造商负责使用一套基于以下内容的分类规则来确定设备的分类:
1.医疗器械的预期用途。
·manufacturer’s intended use of the device
2.对病人,用户及其他人的风险等级。
·level of risk to patients, users and other persons (the probability of occurrence of harm and the severity of that harm)
3.植入人体的程度。
·degree of invasiveness in the human body
4.使用时限。
·duration of use
1)MD医疗器械分类类似于CE MDD
| 类别 | 风险等级 | 举例 |
|---|---|---|
| Class I | 最低 | 手术的牵引器 、压舌板 非灭菌医用口罩/手套 |
| Class I sterile, Class I measuring | 低 | 无菌医用口罩/手套 有特定计量单位的药杯 |
| Class lla | 低偏中等 | 数字或红外温度计 血压计 |
| Class lib | 中等偏高 | 激光手术产品 |
| Class IIl | 高 | 人工心脏瓣膜,可吸收手术缝合线 ,髋关节假体(如髋关节置换) |
| AIMD | 高 | 心脏起搏器 |
2)澳大利亚医疗器械分类标准-IVD
| 类别 | 风险等级 | 举例 |
|---|---|---|
| Class 1 | 无公共卫生风险或低个人风险 | 样品收集容器 ,微生物培养基 |
| Class 2 | 低公共卫生风险或中等个人风险 | 怀孕和生育自测试剂盒 ,胆固醇测试 |
| Class 3 | 中等公共卫生风险或高个人风险 | 性传播疾病(如衣原体,淋病)的测试 ,人类基因检测 |
温馨提示:
与欧盟IVD分类有所差别,与IVDR 趋近,当基于CE去注册TGA时,要特别注意两个地区的差异性。
举例:专业版新冠抗原试剂:欧盟CE 属于IVDD Others--自我符合性声明DoC 澳大利亚TGA属于Class3-TGA强制审核。
认证模式及审核流程:
一、认可部分海外监管机构的授权文件。
- 欧盟成员国医疗器械监管机构指定的公告机构在欧盟医疗器械监管框架下颁发的证书;
- 美国食品和药物管理局 (FDA) 的决定;
- 加拿大卫生部HC颁发的批准和执照;
- 日本的上市前批准(由厚生劳动省 (MHLW)、药品和医疗器械管理局 (PMDA) 或注册认证机构 (RCB) 颁发,适用);
- 根据医疗器械单一审核计划 (MDSAP) *颁发的证书和报告;
- 由认证机构颁发的 ISO 13485:2016 证书,该认证机构也是 IVDD 98/79/EC 下指定的公告机构(仅适用于 2022 年 5 月 26 日之前的 IVD 纳入申请);
- ISO 13485:2016 证书由认可机构颁发,该机构是国际认可论坛 (IAF MLA) 多边认可安排的签署方(仅适用于 2022 年 5 月 26 日之前的 IVD 纳入申请)。
二、TGA合格评定证书(Conformity Assessment CertificatesCAC)。
三、对于系统和程序包:递交自我符合性声明(符合TGA法规要求)。
四、根据TGA法规Schedule3,由满足双边互认协议的发证机构颁发的证书。
什么是澳大利亚代理人(Sponsor)?
TGA注册申请必须通过澳大利亚代理人才能完成,而且在医疗器械标签上要标注出代理人的名字和地址,因此,非澳大利亚医疗器械制造商和IVD制造商指定一位澳大利亚代理人是非常有必要的。
澳大利亚代理人的职责:
● 申请TGA时,为制造商做TGA注册登记;
● 作为制造商和TGA之间的联络人,处理设备投诉、不良事件及召回等工作;
● 根据TGA的要求提供有关设备的信息和文档;
● 提供名称和联络信息(用于产品包装、标签等);
TGA medical device 年费&审核费
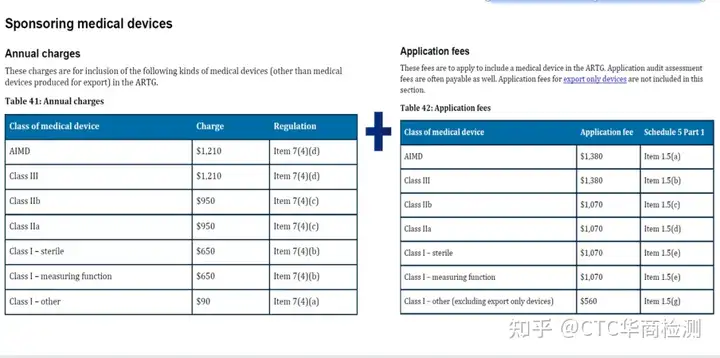

审核流程:
第1步:确认您的产品是否需要纳入ARTG 的医疗器械?
第2步:申请前需要考虑的事项
- 如果您在澳大利亚没有本地机构,请指定一名TGA澳代为您的设备注册提供便利,充当制造商和TGA之间的联络人,并且TGA澳代的名称必须出现在您的设备和标签上
- 医疗器械或IVD医疗器械的分类
- 医疗器械或IVD的制造商证据(TGA通常接受来自公告机构的CE标志证书,也接MDSAP证书)
- 是否指定优先审查
- ARTG 涉及医疗器械或IVD所支持的文件
第3步: 访问 TGA商业服务系统TBS
第4步: 在 TGA TBS 系统中提交|类非无菌、非测量和1类IVD医疗器械的申请
第5步: 在TGA TBS 系统中提交|类医疗器械(仅限出口)和1类IVD医疗器械(仅限出口的申请
第6步: 在TGA TBS 系统中提交申请(适用于除1类非无菌、非测量医疗器械、1类IVD医疗器械和1类医疗器械/1类IVD医疗器械出口外的所有类别)
第7步: TGA 将批准或拒绝您的申请。如果获得TGA批准,将颁发澳大利亚治疗商品登记(ARTG)列表编号(ARTG包含证书),您的列表将包含在TGA网站上的ARTG数据库中。
第8步: 打印 ARTG 证书
第9步: 产品上市后监管
根据 TGA 法规,澳大利亚的医疗器械是否有特定的标签或包装要求?
是的,根据 TGA 法规,澳大利亚对医疗器械有特定的标签和包装要求。这些要求旨在确保医疗器械有正确的标签和包装,以便安全有效地使用。
澳大利亚医疗器械的标签要求在《2008 年治疗用品(标签)条例》中规定。标签必须包含以下信息:
- 制造商、包装商或经销商的名称和地址
- 设备的商品名称或品牌名称
- 唯一设备标识符 (UDI)
- 设备的预期用途
- 使用说明
- 任何警告或预防措施
- 到期日(如果适用)
- 批次或批号
澳大利亚医疗器械的包装要求在 2008 年治疗用品(包装)法规中规定。包装的设计必须能够保护器械免受损坏并防止其被错误使用。包装还必须包含以下信息:
- 制造商、包装商或经销商的名称和地址
- 设备的商品名称或品牌名称
- 唯一设备标识符 (UDI)
- 设备的预期用途
- 使用说明
- 任何警告或预防措施
- 到期日(如果适用)
- 批次或批号
除了标签和包装要求外,澳大利亚的医疗器械还必须遵守 2002 年治疗用品(质量管理)法规。这些法规要求制造商建立质量管理体系 (QMS),以确保设备的制造和销售经过高标准测试。
证书样本:


部分过审案例
最新资讯文章
- · 澳洲医疗器械TGA注册怎么办理?流程怎么样?
- · 沙特医疗器械SFDA(MDMA)认证怎么办理?周期多久?
- · 加拿大医疗器械许可MDEL和MDL如何申请?怎么收费?
- · 珠宝饰品上亚马逊/TEMU要求ASTM F2923-20怎么办理?周期可以加急吗?
- · 哪些产品出口日本需要申请PSE和METI备案,哪里可以查询?
- · 亚马逊含纽扣电池产品或硬币电池gcc/UL4200A怎么办理?样品需要多少?
- · 什么是欧盟包装指令?包装指令测试样品需要多少?
- · GRS认证是什么?Grs认证的申请流程怎么样?
- · 你是不是因为可回收包装袋警示语而困扰,这篇文章教会你
- · 西班牙包装回收SCRAP注册周期多久?可以加急吗?
推荐资讯文章
- · 床垫上架TEMU,亚马逊合规要求16 CFR Part 1633是什么?测试要求有哪些?
- · 珠宝饰品上亚马逊/TEMU要求ASTM F2923-20怎么办理?周期可以加急吗?
- · 哪些LED灯具需要申请国内强制性CCC认证?
- · 机动车轮胎CCC认证标准以及范围
- · 短距离无线电设备SRRC认证标准及规范
- · 沙特SASO认证食品接触材料新规将于2020年1月1日执行
- · 喷射式玩具亚马逊销售需要哪些合规认证?测试要求有哪些?
- · 音视频产品CCC认证执行新版标准GB 8898-2001
- · 燃气具CE认证2016/426 (GAR)指令好办理吗?周期多久?免收重测费
- · 适用强制性产品认证自我声明评价方式产品清单












